BAB I
PENDAHULUAN
1.1 Latar
Belakang
Industri adalah hal yang tidak dapat
dipisahkan dari kehidupan dari kehidupan manusia. Kemajuan suatu negara dapat
dilihat dari perkembangan industri. Jika membicarakan industry, maka kita tidak
dapat memisahkan dari proses produksi. Proses produksi yang terjadi di dalam
industri kimia pastinya selalu melibatkan suatu proses kimia. Beberapa reaksi
kimia yang terdapat dalam industri kimia adalah reaksi redoks, reaksi
sulfonasi, reaksi nirasi, reaksi halogenasi dan reaksi hidrogenasi.
Pada makalah ini akan dibahas
salah satu proses kimia yaitu proses nitrasi. Nitrasi yaitu suatu reaksi terbentuknya senyawa nitro atau masuknya gugus nitro pada suatu senyawa. Biasanya dilakukan dengan
campuran asam sulfat dan asam nitrat atau yang biasa disebut dengan mixed acid. Guna asam asam sulfat dalam nitrasi ini adalah
sebagai zat penarik air (pada reaksi nitrasi akan terbentuk air), sehingga reaksi berlangsung sampai
berakhir. Nitrasi merupakan reaksi isotermis, yaitu reaksi yang menghasikan zat – zat yang dapat meledak. Proses nitrasi banyak digunakan dalam industri kimia
seperti industri pengolahan kelapa sawit, pengolahan plastik, industri bahan
peledak, dll.
1.2 Rumusan
Masalah
1. Apa itu proses nitrasi ?
2. Apa saja reagen atau zat penitrasi yang
digunakan ?
3. Apa saja macam-macam proses nitrasi ?
4. Bagaimana thermodinamika reaksi nitrasi
?
5. Apa
saja aplikasi penggunaan proses nitrasi ?
1.3 Tujuan
1. Mengetahui apa itu proses nitrasi.
2. mengetahui zat penitrasi yang digunakan
dalam proses nitrasi.
3. Mengetahui macam-macam proses nitrasi.
4. Mengetahui thermodinamika reaksi
nitrasi.
5. Mengetahui aplikasi proses nitrasi.
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Nitrasi
Nitrasi diartikan sebagai reaksi terbentuknya senyawa nitro atau masuknya
gugus nitro pada
suatu senyawa. Biasanya dilakukan dengan campuran asam sulfat dan asam nitrat atau yang biasa disebut dengan mixed acid. Guna asam
asam sulfat dalam nitrasi ini adalah sebagai zat penarik air (pada reaksi nitrasi akan terbentuk air), sehingga reaksi berlangsung sampai berakhir. Nitrasi
merupakan reaksi isotermis, yaitu reaksi yang menghasikan zat – zat yang dapat meledak.
Saat proses nitrasi, gugus nitro
akan menggantikan atom monovalen atau beberapa group atom. Pada reaksi nitrasi,
gugus nitro dapat berikatan dengan atom yang berbeda, yaitu :
a.
Gugus nitro yang berikatan dengan atom Karbon (C) akan membentuk senyawa
nitroaromatik atau nitroparafinik.
b.
Gugus nitro yang berikatan dengan atom Oksigen (O) akan membentuk senyawa
nitrat ester
c.
Gugus nitro yang berikatan dengan ataom Nitrogen (N) akan membentuk senyawa
nitramin
Gugus nitro yang berikatan dengan atom hidrogen akan banyak dibahas karena
reaksi tersebut merupakan kepentingan teknis yang terbesar. Pada alkil halida
tertentu dapat bereaksi dengan perak nitrat dan menghasilkan nitrat ester, atau
bereaksi dengan perak nitrit dan menghasilkan suatu senyawa nitro seperti yang
ditunjukkan oleh reaksi berikut ini.
RCl + AgNO3 è RONO2 + AgCl
RCl + AgNO2 è RONO2 + AgCl
Pada jenis nitrasi aromatik yang terjadi pada asam sulfonat atau golongan
asetil, gugus nitro dapat melakukan substitusi seperti pada gambar berikut.
Gambar 1. Reaksi nitrasi pada senyawa aromatic
Nitrasi merupakan suatu reaksi yang sangat penting pada sebuah industri,
terutama industri yang bergerak pada bidang kimia organik sintetis. Produk yang
banyak dihasilkan dari hasil nitrasi adalah pelarut, pewarna, bahan peledak,
dan juga dalam bidang farmasi. Hasil dari reaksi nitrasi juga dapat
menghasilkan amina, yaitu dari reaksi reduksi senyawa nitro.
2.2 Penitrasi
Berbagai macam reagen dapat
digunakan dalam proses nitrasi. Reagen tersebut adalah asam nitrat (gas, pekat,
maupun dalam bentuk larutan), campuran asam nitrat dan asam sulfat (mixed acid), asetat anihidrida, asam
asetat, asam fosfat, dan kloroform. Nitrogen pentaoksida (N2O5)
dan nitrogen tetraoksida (N2O4) juga digunakan dalam
reaksi nitrasi dalam fasa gas
Mixed acid adalah media nitrasi yang paling
penting dan mungkin juga media yang paling baik diantara semua media penitrasi
lainnya. Penelitian menyebutkan bahwa terdapat asam nitrat berbentuk ion Nitril
(NO2+) di dalam asam sulfat. Reaksi ionisasi asam nitrat
dapat dituliskan dalam persamaan berikut.
HNO3 + 2H2SO4 è NO2+ + H3O+
+ 2HSO4-
Larutan asam nitrat memiliki tiga
jenis spektrum penyerap ultraviolet yang berbeda. Pada larutan yang encer,
spektrum muncul karena adanya ion nitrat (NO3-). Pada
pelarut polar inert yang lemah seperti kloroform, spektrumnya sama dengan etil
nitrat, menunjukkan bahwa terdapat kandungan asam nitrat dalam bentuk HNO3
yang belum terionisasi. Spektrum jenis ketiga adalah karakteristik dari larutan
asam sulfat dari asam nitrat dan esternya, menunjukkan bahwa tidak ada
kandungan asam nitrat, baik dalam bentuk ion nitrat maupun dalam bentuk HNO3
yang belum terionisasi.
Ion yang berasal dari asam nitrat
pada asam sulfat memiliki muatan positif. Hal tersebut telah dibuktikan dengan
percobaan elektrolisis. Dari percobaan elektrolisis tersebut ditemukan bahwa
asam nitrat bergerak dari anoda ke katoda.
Hubungan antara jumlah air yang terdapat dalam asam sulfat dengan persen
molekul asam nitrat yang terionisasi untuk membentuk ion nitril terdapat pada
grafik berikut.
Gambar 2. Efek kandungan air pada ionisasi asam nitrat
pada asam sulfat
Berdasarkan grafik pada gambar 2, saat konsentrasi asam sulfat kurang dari
86%, ionisasi asam nitrat yang terjadi sangat sedikit tetapi terus meningkat
dengan cepat seiring dengan konsentrasi asam sulfat yang semakin besar. Pada
konsentrasi asam sulfat sebesar 94%, asam nitrat telah terionisasi sempurna
menjadi ion nitril.
2.3 Nitrasi Aromatik
Nitrasi senyawa aromatik dapat digambarkan dengan persamaan sebagai
berikut.
ArH + HNO3 è ArNO2 + H2O
Senyawa penitrasi merupakan
reaktan yang bersifat elektrofilik, yaitu sifat suatu senyawa yang memiliki
kecenderungan untuk “menyukai” elektron karena senyawa itu sendiri kekurangan
elektron. Reaksi akan terjadi pada atom karbon di dalam cincin aromatik dimana
kerapatan elektronnya paling besar. Gugus nitro dapat masuk pada posisi ortho,
meta, atau para (sebagai isomernya). Proporsi dari produk isomer ini bergantung
pada jenis substituennya karena substituen memiliki efek yang besar pada
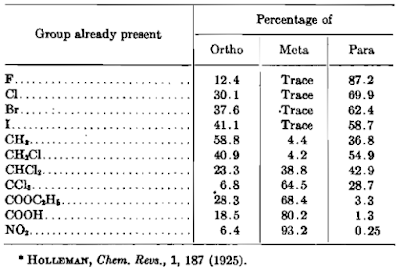
kerapatan elektron di sekitar atom karbon. Perbandingan proporsi ortho, meta,
dan para dari berbagai substituen terdapat pada tabel berikut.
Table 2.1. Nitration of Various Monosubstituted
Benzenes.
Pada tabel di atas terlihat bahwa proporsi ortho, meta, dan para berbeda
setiap substituennya.
2.4 Nitrasi Naftalena dan Anthraquinon
Pada reaksi nitrasi naftalena, sebanyak dua buah gugus nitro memungkinkan
untuk masuk ke dalam cincin aromatik dan membentuk 1-nitronaftalena dan
2-nitronaftalena. Saat nitrasi, gugus nitro yang pertama akan masuk ke posisi
alfa (α) atau posisi 1, sedangkan gugus nitro yang kedua akan masuk ke posisi 5
atau 8.
Pada reaksi nitrasi anthraquinon, gugus nitro yang memungkinkan untuk masuk
ke dalam cincin aromatik adalah sebanyak tiga buah (dengan menggunakan mixed acid). Produk yang dihasilkan adalah 1-nitroanthraquinon, 1,5-dinitroanthraquinon,
dan 1,8-dinitroanthraquinon.
2.5 Teori Substitusi Aromatik
Substituen dapat mempengaruhi
kerapatan elektron dengan menggunakan dua jenis efek, yaitu efek Induktif (I)
dan efek Mesomeri (M). Terdapat dua jenis efek induktif, yaitu efek –I yang
menarik elektron dan efek +I yang menolak elektron. Hal yang sama juga terjadi
pada efek Mesomeri (–M dan +M). Efek induktif sangat berkaitan dengan momen
dipol dari senyawa, seperti C6H5 – X. Jika X berada pada dipol/kutub negatif,
maka X tersebut akan menarik elektron keluar cincin dan efek yang timbul adalah
efek –I. Jika X berada pada kutub positif, maka kerapatan elektron pada cincin
aromatik akan bertambah karena elektron tidak keluar dari cincin, sehingga efek
yang timbul adalah efek +I. Gugus yang menghasilkan efek –I adalah –Nme3+,
–NO2, –COOEt, dan –halogen. Gugus yang menghasilkan efek +I adalah –O-
dan beberapa jenis alkil. Efek +I mengakibatkan seluruh posisi di dalam cincin
semakin reaktif dan semakin kuat daripada posisi pada benzena yang belum
tersubstitusi, sehingga posisi ortho dan para akan lebih reaktif daripada
posisi meta. Efek –I akan menurunkan tingkat reaktivitas dari seluruh posisi
pada cincin benzena. Akan tetapi, efek penurunan reaktivitas tersebut
berpengaruh lebih besar pada posisi ortho dan para, sehingga posisi meta lebih
reaktif.
Jenis substituen yang memiliki elektron bebas dapat meningkatkan kerapatan
elektron dalam cincin aromatik karena efek mesomeri +M. Jenis substituen
lainnya dapat menurunkan kerapatan elektron dalam cincin aromatik karena efek –M.
Ilustrasi dari efek mesomeri yaitu sebagai berikut.
Gambar a menunjukkan efek mesomeri +M karena terjadi perpindahan elektron
dari substituen menuju cincin aromatik. Perpindahan tersebut akan menyebabkan
cincin aromatik akan semakin kuat pada posisi orto dan para daripada posisi
meta. Gambar b menunjukkan efek mesomeri –M karena terjadi perpindahan elektron
keluar dari cincin aromatik menuju substituen. Perpindahan tersebut akan
menyebabkan seluruh posisi dalam cincin terdeaktivasi, tetapi posisi meta lebih
sedikit terkena deaktivasi tersebut. Group yang menunjukkan efek +I dan +M
pasti tersubstitusi pada posisi ortho dan para, sedangkan group yang menunjukkan efek –I akan mengakibatkan proses
substitusi menjadi lebih sulit sehingga akan lebih dominan ke posisi met.a
Ketika dua efek yang bertentangan direaksikan, maka produk yang dihasilkan akan
lebih sulit diprediksi. Efek bertentangan tersebut contohnya efek +I dan –M
serta –I dan +M.
2.6 Rasio Ortho : Para
Efek substituen terhadap rasio ortho:para dapat dipengaruhi oleh faktor
lain, seperti faktor sterik (ukuran substituen). Semakin besar ukuran
substituen, maka semakin sulit pula untuk mencapai posisi ortho dan rasio
produk ortho:para juga semakin kecil. Contoh yang dapat diambil adalah proses mononitrasi alkilbenzena seperti yang
ditunjukkan pada tabel berikut.
Table 2.2.. Proportion of Products Formed in the
nitrations of alkylbenzenes.
Tabel diatas menunjukkan bahwa
semakin besar ukuran substituen, maka kemungkinan untuk berada di posisi ortho
atau para akan semakin kecil dan rasio ortho:para akan menurun.
Faktor lain yang dapat
mempengaruhi rasio ortho:para adalah efek I dan M seperti yang dijelaskan pada
bagian sebelumnya. Efek induktif akan bekerja lebih kuat pada posisi ortho
daripada posisi para, sedangkan efek mesomeri akan lebih kuat pada posisi para
daripada posisi ortho. Senyawa yang memiliki efek +I, akan menghasilkan rasio yield ortho:para yang lebih besar
daripada senyawa yang memiliki dominan efek + M. Begitu juga dengan senyawa
yang efek dominannya adalah –I akan menghasilkan rasio yield ortho:para yang lebih kecil daripada senyawa yang memiliki
dominan efek –M.
Rasio ortho:para juga dipengaruhi
oleh media nitrasinya. Distribusi isomer yang hasilnya berasal dari nitrasi
anilina dan anilida pada beberapa macam media terdapat pada tabel berikut.
Table 2.3. Nitration of Aniline and anilides
Nitration with 80 per cent HNO3 in glacial
acetic acid
Table 2.4. Nitration of Analine and Anilides
(Continued)
Nitration with 94 per cent HNO3 in
concentrated H2SO4
Nitrasi asetalinida dengan senyawa penitrasi mixed acid menghasilkan nitroasetanilida dengan rasio ortho:para
kurang dari 0,1. Ketika medium nitrasinya dalam asam nitrat, rasio ortho:para
nya sebesar 0,7, dan ketika medium yang digunakan adalah asetil nitrat di dalam
asetat anihidrida, produk seluruhnya adalah o-nitroasetanilida.
Pada asam kuat (asam nitrat dan asam sulfat), aniline sangat terionisasi. Persamaan
reaksinya adalah sebagai berikut.
C6H5NH2 + HA + C6H5NH3+
+ A-
Ion anilium (C6H5NH3+) akan
terdeaktivasi karena efek –I pada substituen –NH3+. Nitrasi
tersebut akan menghasilkan isomer pada posisi meta. Senyawa amina bebas akan
teraktivasi karena efek +M dari group –NH2- sehingga
menghasilkan isomer posisi para. Pada lingkungan asam lemah seperti asam
asetat, konsentrasi ion anilium lebih sedikit daripada asam kuat.
2.7 Kinetik dan Mekanisme Nitrasi Aromatik
Kinetika reaksi nitrasi bergantung pada media reaksinya. Misalnya reaksi
terjadi pada asam sulfat. Senyawa yang mengalami nitrasi pada keadaan tersebut
adalah senyawa yang memiliki efek efek –I dan efek –M yang kuat seperti
nitrobenzena, anthraquinon, dan etil benzoat. Laju dari nitrasi tersebut
sebanding dengan konsentrasi asam nitrat dan substrat organik lain yang
ditambahkan. Laju reaksinya adalah sebagai berikut.
Rate = k (HNO3) (ArH)
Efek dari kandungan air pada proses nitrasi ditunjukkan oleh grafik di
bawah ini.
Gambar 3. Efek kandungan air pada nitrasi dan ionisasi
trifenil karbinol
Laju reaksi akan meningkat dengan tajam seiring dengan meninggkatnya
konsentrasi asam sulfat dan mencapai titik maksimum pada saat konsentrasi asam
sulfat sebesar 90%. Akan tetapi, laju reaksinya menurun drastis pada saat
konsentrasi asam sulfat lebih dari 90%. Kenaikan laju reaksi disebabkan karena
naiknya konsentrasi ion nitril yang terbentuk. Grafik tersebut juga menunjukkan
konstanta kesetimbangan (k) dari tris p-nitrofenilkarbinol
meningkat seiring dengan meningkatnya laju reaksi. Trifenilkarbinol akan
mengalami ionisasi dalam asam sulfat dan menghasilkan ion karbonium seperti
yang terjadi pada ionisasi asam nitrat yang menghasilkan ion nitril. Reaksi
yang terjadi adalah :
(Ar)3COH + 2H2SO4 è (Ar)2C+ + H3O + 2HSO4-
Sesuai dengan grafik pada gambar 3, laju reaksi nitrasi akan menurun pada
saat konsentrasi asam sulfat di atas 90%. Penyebabnya adalah adanya interaksi
antara substrat organik dan asam sulfat sehingga akan menurunkan kerapatan
elektron di dalam cincin. Penurunan kerapatan elektron tersebut akan
mengakibatkan berkurangnya reaktivitas dari cincin tersebut. Kemungkinan interaksi
yang terjadi adalah pembentukan ikatan Hidrogen antara nitrobenzena dan asam
sulfat. Kekuatan ikatan tersebut akan semakin kuat pada keadaan asam (dalam hal
ini adalah asam sulfat). Berkurangnya kandungan air pada asam sulfat (kenaikan
konsentrasi asam sulfat) akan meningkatkan interaksi yang semakin kuat antara
asam dan substrat organik sehingga elektron akan semakin keluar dari cincin. Keluarnya
elektron tersebut mengakibatkan laju reaksi nitrasi menurun.
2.8 Nitrasi pada Pelarut Organik
Pada pelarut organik seperti nitrometana atau asam asetat, proses kinetika
nitrasinya bergantung pada senyawa aromatik yang akan dinitrasi. Senyawa
seperti nitrobenzena atau etil benzoat yang merupakan group pendeaktivasi, akan
dinitrasi pada laju yang sebanding dengan konsentrasi substratnya (reaksi orde
satu). Senyawa yang lebih reaktif dari benzena (toluen, xilene, p-kloranisol) akan bereaksi pada laju
yang berbeda dengan substratnya (reaksi orde nol). Mekanisme pembentukan ion
nitril adalah sebagai berikut.
2HNO3 è H2NO3 + NO3-
H2NO3+ è H2O + NO2+
Langkah pertama yaitu proses transfer proton dari satu molekul asam nitrat
ke molekul asam nitrat lainnya dengan sangat cepat. Laju reaksi langkah kedua,
yaitu pembentukan ion nitril, bergantung kepada media yang digunakan. Pada asam
kuat, pelarut yang sangat polar (asam sulfat pekat), reaksi akan berjalan
sangat cepat. Sebaliknya, pada asam yang relatif lemah seperti asam asetat atau
nitrometana, reaksi tersebut akan berjalan lambat.
2.9 Nitrasi pada Larutan Asam Nitrat
Substrat yang sangat reaktif akan menunjukkan reaksi berorde nol, sedangkan
senyawa yang kurang reaktif akan menunjukkan reaksi berorde satu (pada 40%
larutan asam nitrat). Laju reaksi nitrasi dari senyawa reaktif akan sama dengan
laju pertukaran O18 antara HNO318 dan H2O16.
Pertukaran oksigen anatara asam nitrat
dan air terjadi pada reaksi berikut ini :
2HNO318  H2NO318+ + NO318-
H2NO318+ + NO318-
H2NO318+  H2O18 + NO218+
H2O18 + NO218+
ion nitril yang
terbentuk akan segera bereaksi dengan air
NO218+ + H2O16
è H2NO16O218+
2.10 Efek Asam Nitrit pada Nitrasi
Asam nitrit (HNO2) atau nitrogen dioksida (NO2) dapat
menghambat reaksi (inhibitor), dan dapat juga mempercepat reaksi (katalis). Efek
menghambat terjadi ketika nitrasi terjadi pada senyawa yang tidak memiliki
gugus pengaktivasi, yang reaksinya menggunakan medium asam nitrat kuat atau mixed acid. Pada media tersebut asam
nitrit akan membentuk ion nitrosil (NO+).
HNO2 + HNO3 è NO3- + NO3-
+ NO+ + H2O
HNO2 + 2H2SO4 è H3O+ + 2HSO4-
+ NO+
Ion nitrosil yang terbentuk akan mengurangi konsentrasi ion nitril sehingga
menurunkan laju reaksinya. Efek mempercepat reaksi terjadi pada nitrasi substrat
reaktif seperti anisol atau dimetianilina, yang reaksinya menggunakan asam
nitrat lemah (konsentrasi ion nitril rendah). Efek katalitik muncul karena
pembentukan senyawa nitroso yang teroksidasi menjadi senyawa nitro. Mekanismenya
adalah.
ArH + NO+ è ArNO + H+
ArNO + HNO3 è ArNO2 + HNO2
Ion nitrosil bersifat lebih lemah daripada ion nitril, sehingga ion
tersebut hanya dapat bereaksi dengan senyawa aromatik yang sangat reaktif
seperti anisol atau dimetilanilina. Syarat yang harus terpenuhi agar asam
nitrit bisa menyebabkan reaksi katalitik adalah :
a. Substrat yang digunakan harus
cukup reaktif, sehingga ion nitrosil bisa menyerang dengan mudah.
b. Media reaksi harus memiliki
konsentrasi ion nitril yang rendah, sehingga ion nitrosil dapat berkompetisi
dengan ion nitril secarasetara untuk berikatan dengan substrat
2.11 Oksinitrasi
Oksinitrasi adalah reaksi yang terjadi antara benzena dan sekitar 50% asam
nitrat yang mengandung 0,2 molar merkuri nitrat. Hasil dari reaksi tersebut
adalah 85% dinitrofenol dan asam picric. Mekanisme yang terjadi saat
oksinitrasi adalah sebagai berikut :
Mula-mula benzena akan dikonversi menjdi fenilmerkuri nitrat yang kemudian
akan direaksikan dengan nitrogen dioksida untuk membentuk nitrosobenzena. Nitrosobenzena
yang dihasilkan dapat bereaksi dengan dua cara. Pada asam nitrat (<50%),
nitrosobenzena akan bereaksi dengan nitrogen oksida dan menghasilkan
fenilazodium nitrat. Garam diazonium yang terbentuk dari reaksi selanjutnya
akan dikonversi menjadi fenol dengan bantuan air, yang kemudian akan dinitrasi
dan menjadi produk akhir. Pada asam nitrat (>50%), nitrosobenzena dikonversi
secara langsung menjadi p-nitrofenol
tanpa melalui pembentukan senyawa diazonium. P-nitrofenol yang terbentuk kemudia dinitrasi dan menghasilkan
dinitrofenol dan asam picric.
2.12 Nitrasi pada Senyawa Parafin
2.12.1 Reaksi Fasa Gas
Tidak seperti nitrasi aromatik yang mudah diserang oleh reagen elektrofilik
seperti ion nitril, senyawa parafin memiliki sifat inert kepada reagen
tersebut. Senyawa parafin sangat rentan diserang oleh atom tertentu dan radikal
bebas. Pada reaksi nitrasi senyawa parafin, ciri-ciri yangterjadi adalah :
a. Terdapat temperatur optimum dimana didapatkan yield tertinggi.
Dengan menggunakan butana dan
asam nitrat pekat (rasio 15:1), waktu kontak sebesar 1,6 detik, hasil nya
adalah sebagai berikut.
Tabel diatas menunjukkan konversi asam nitrat terbesar pada temperatur 425oC.
Pada temperatur 435oC konversi asam nitrat dan yield berdasarkan butana menurun.
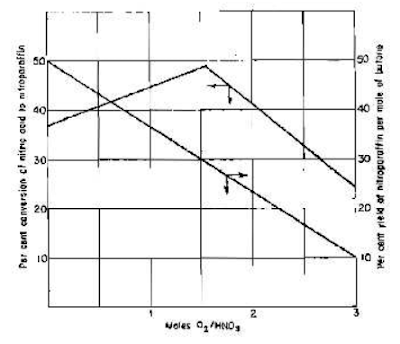
b. Penambahan oksigen meningkatkan yield
berdasarkan asam nitrat tetapi juga menaikkan oksidasi butana.
Efek yang ditimbulkan ditunjukkan pada grafik di bawah ini.
Penambahan oksigen juga meningkatkan produksi nitrometana dan nitroetana,
tetapi menurunkan produk nitrobutana. Ketika rasio O2:HNO3
= 1, yield berdasarkan butana yang
bereaksi meningkat dari 32% ke 45%. Penggunaan uap sebagai pencair dengan
bantuan oksigen juga mengurangi efek oksidatif dari oksigen dan membantu
meningkatkan konversi.
c. Nitrogen bereaksi dengan parafin dan menghasilkan nitroparafin.
Pada temperatur 325oC, waktu kontak selama 1,9 menit, rasio
propana:NO2 = 4,2, konversi NO2 sebesar 16,6% dan yield berdasarkan mol hidrokarbon
sebesar 51%. Penambahan oksigen akan menurunkan temperatur optimum serta
meningkatkan konversi dan yield. Pada
temperatur 285oC, waktu kontak 3 menit, rasio O2:NO2
= 0,75, konversinya adalah sebesar 29% dan yield
sebesar 71%.
d. Bromin memiliki efek menguntungkan terhadap konversi dan yield nitroparafin dengan menggunakan
asam nitrat.
Pada temperatur 423oC, waktu kontak selama 1,5 detik, rasio
propana:O2 = 8,2, rasio propana:asam nitrat = 9,9, rasio air:asam
nitrat = 15, dan Br2:HNO3 = 0,015, konversi yang terjadi
adalah sebesar 55,5%. Produk lainnya yang terbentuk yaitu :
CO2 = 0 %
CO = 3, 6%
C3H6 = 9,7 %
C2H4 = 4,1 %
aldehida dan keton
= 27 %
e. Hidrokarbon dengan cabang yang banyak akan mengalami pembelahan yang lebih
sedikit daripada isomernya yang bercabang lebih sedikit.
Substitusi hidrogen lebih memungkinkan untuk terjadi ketika struktur
hidrokarbon bercabang banyak mengalami nitrasi. Perbandingan nitrasi isomer
butana dan pentana berdasarkan rasio molar produk yang diakibatkan oleh
pembelahan ditunjukkan pada tabel berikut ini.
Ketika skeleton karbon lebih semakin bercabang, substitusi hidrogen semakin
berkurang.
f. Koefisien temperatur untuk substitusi hidrogen berada pada urutan primer
> sekunder > tersier.
Laju substitusi akan berlawanan pada temperatur yang rendah. Seiring dengan
meningkatnya temperatur reaksi, laju reaksinya juga semakin setara.
2.12.2 Reaksi Fasa Liquid
Reaksi ini tidak begitu banyak
dilakukan karena yield yang dihasilkan sedikit, konversi yang terjadi rendah,
dan munculnya reaksi-reaksi samping yang tidak diinginkan. Prinsip nitrasi liquid ini adalah pergantian
atom hidrogen dengan gugus nitro. Reaksi ini berjalan relatif lambat karena
kelarutan antara senyawa parafin dan medium nitrasi rendah. Karena titik didih
parafin yang lebih tinggi, hidrokarbon bercabang banyak dapat dinitrasi pada
temperatur yang tinggi dan reaksi berjalan lebih cepat daripada hidrokarbon
yang memiliki berat molekul kecil.
Mononitroparafin yang pertama
kali terbentuk bersifat lebih larut pada asam nitrat daripada hidrokarbon,
sehingga reaksi akan terus berlanjut dan menghasilkan polinitroparafin. Hasil
lainnya adalah produk oksidasi berupa asam lemak, alkohol, dan oksida karbon.
Ketika parafin bercabang banyak pada fasa liquid dinitrasi dengan asam
nitrat pada fasa vapor, reaksi akan berjalan lancar pada temperatur yang
rendah. Pencampuran reaktan dicapai dengan cara mengalirkan asam nitrat melalui
kumparan yang terhubung dengan senyawa parafin liquid. Liquid parafin dijaga
temperaturnya agar tetap diatas 121oC (titik didih maksimum dari
65-70% asam nitrat), sedangkan uap asam yang terbentuk didifusikan melalui plat
berpori dan membentuk gelembung. Tabel di bawah ini menunjukkan hasil nitrasi n-dodekana pada suhu 180-190oC
dengan menggunakan prosedur yang sama.

Data diatas menunjukkan bahwa rasio asam nitrat:parafin yang besar akan
mengakibatkan terbnetuknya senyawa polinitro dan asam lemak dalam jumlah yang
besar. ketika rasio parafin:asam nitrat dikurangi menjadi 1:2, hanya 42%
parafin yang telah digunakan dan produk utamanya adalah mononitrododekana. Sejumlah parafin (sampai dengan 19%,
tergantung pada kondisi) akan rusak karena proses oksidasi.
2.13 Nitrasi Olefin Fasa Liquid
Senyawa penitrasi yang digunakan biasanya adalah Nitrogen dioksida. Penambahan
udara juga dilakukan untuk mengoksidasi senyawa nitrat oksida menjadi dioksida.
Produk mula-mula adalah dinitroparafin dan nitronitrit. Senyawa nitronitrit
yang tidak stabil akan dioksidasi dengan bantuan udara menjadi senyawa yang
lebih stabil, yaitu nitronitrat. Nitronitrit yang tersisa akan dikonversi
menjadi nitroalkohol.

Reaksi dilakukan dengan penambahan olefin ke dalam nitogen dioksida secara
perlahan pasa temperatur sebesar -10 sampai +25oC. Penggunaan eter
sebagai pelarut makan meminimalisisr reaksi samping yang bersifat oksidatif. Reaksi
dapat berlangsung selama 1-2 jam. Total yield
yang dihasilkan adalah sebesar 65-85%.
2.14 Thermodinamika
Nitrasi
Reaksi
nitrasi adalah reaksi yang sangat eksotermik karena melepaskan panas.
Permasalahan panas dititikberatkan karena panas cairan asam penitrasi yang
akibat esensial untuk pemahaman yang memadai tentanng proses unit.
Sebuah
fungsi yang sesuai untuk digunakan dalam perhitungan tersebut adalah entalpi
(H), atau disebut juga kandungan panas yang terkandung. Karakteristik dari
fungsi ini yaitu memiliki nilai tertentu disetiap bagian tertentu pada system,
nilainya ditentukan seluruhnya oleh temperatur , tekanan, komposisi dan setiap
koordinat thermodinamik lainnya yang
bersangkutan. Nilai ∆H ditentukan semata-mata oleh besaran H di bagian
awal dan akhir dan tidak terpengaruh oleh proses di mana sistem tersebut
berpindah dari satu bagian ke bagian yang lain. Dalam perubahan eksotermik,
entalpi akan menurun. Besarnya penurunan setara dengan panas yang hilang,
tetapi ini terjadi bila hasil reaksi tanpa kinerja yang berguna dan ketika
sistem dibawa kembali ke suhu dan tekanan awal.
Asumsi bahwa kondisi ini
terus belangsung secara implisit yang biasanya penulisan persamaan termokimia,
di mana ∆H berarti panas yang benar-benar diserap dalam reaksi jumlah berat
yang menunjukkan rumus gram. Misalnya, pembentukan benzena dari unsur-unsurnya
ditulis:
6C(diamond)
+ 3H2 (gas) è C6H6
(liquid) ΔH295K = +9,7
kg-cal
Hal ini menunjukkan
reaksi yng terjadi membutuhkan 6 g atom
atau 72,1 g karbon dan 3 mol atau 6 g hidrogen untuk membentuk benzena cair.
Perubahan entalpi sebagaimana tertulis diartikan bahwa jumlah yang bereaksi
pada tekanan konstan dan pada suhu konstan yaitu 295oK (22oC
atau 71.6oF) menyerap 9,7 kg-cal panas dari sekitarnya. Perubahan
entalpi positif tersebut menunjukkan reaksi endoterm. Nitrasi, di sisi lain,
seperti yang telah disebutkan, adalah sangat eksotermik dan perubahan entalpi
bernilai negatif.
1. Panas
yang di hasilkan dari Nitrasi.
Reaksi
nitrasi harus dikontrol oleh pendinginan sistemik yang dirancang untuk
mennyerap energi yang berubah. Ketika
semua set energi bebas dengan reaksi eksotermis maka akan muncul sebagai panas,
jumlah panas itu akan hilang karena menggunakan mekanisme pendinginan yang sama
saaj dengan penurunan entalpi:
Di sini Q, panas reaksi,
merupakan jumlah total panas yang hilang oleh sistem yang bereaksi dari awal
reaksi sampai produk dan kembali ke suhu dan tekanan awal dari sistem.
2. Sifat
thermal nitrasi asam
Memanaskan larutan. Untuk
menentukan panas yang berubah selama proses nitrasi hidrokarbon oleh asam
campuran, tidak hanya perlu mempertimbangkan panas nitrasi tetapi juga berbagai
memanaskan larutan. Ini dapat diperoleh dari tabel entalpi yang dikembangkan
oleh Mc Kinley dan Brown. Untuk masing-masing dari tiga komponen, entalpi
diambil sebagai nol pada keadaan standar, yang terdiri dari komponen cairan
murni pada suhu 32oF dan tekanan 1 atm. Diplot terhadap absis yang
sama tetapi melawan koordinat yang berbeda adalah data panas spesifik untuk
sistem. Dari angka ini, yang mengandung kedua entalpi relatif 32oF
dan spesifik memanaskan, entalpi dari setiap campuran cair dari komponen pada
suhu biasa dapat dengan mudah dihitung dengan membaca entalpi relatif
diinginkan di 32oF.
3. Integrasi
kalor nitrasi
Dalam
nitrasi hidrokarbon dengan cara campuran nitrat pekat dan asam sulfat, total
panas dibebaskan adalah sama dengan panas larutan asam campuran awal minus
panas larutan asam menghabiskan akhir minus panas larutan asam nitrat memasuki
reaksi ditambah panas dari reaksi nitrasi. Meskipun memanaskan nitrasi yang
relatif besar, kontrol cara paling sederhana untuk mengintegrasikan reaksi efek
panas yang terlibat dalam menjumlahkan entalpi pada kedua sisi persamaan reaksi
lengkap dengan menggunakan kalor nitrasi
Metode
ini dapat diilustrasikan dengan menggunakan data operasi khas untuk nitrasi
benzena dalam nitrator Hough. Ini mengikuti digambarkan sebagai "nitrasi
tidak langsung" dalam detik. XI. The nitrator hough ditandai oleh dua
terowongan eksternal, masing-masing dilengkapi dengan pengaduk. Sirkulasi asam
siklus dan asam diperkaya sampai melalui terowongan dan luapan melalui port ke
dalam tubuh utama nitrator dan melewati kumparan pendingin. Benzena yang akan
dimasukkan ke nitrasi asam siklus difortifikasi dalam terowongan dan mengapung
di atas asam siklus. Tingkat asam siklus atau asam diperkaya disimpan di atas
tingkat overflow dari port, dan pada dasarnya itu adalah asam yang bersirkulasi
melalui terowongan sebagai hasil nitrasi. Segera setelah memperkuat umpan asam
dimulai ke dalam terowongan, dengan metode yang sama sebagai umpan hidrokarbon
awal, siklus ditarik melalui bagian bawah nitrator tersebut. Tingkat pada nitrator
yang demikian dipertahankan konstan. Asam siklus ditarik mengandung sejumlah
kecil nitrobenzena dan kemudian dikembalikan ke proses sebagai asam siklus
untuk berhasil nitrations. Sebuah diagram dari nitrator Hough.

4. Datatermal yang berkaitan dengan
persiapan dan penggunaan senyawa nitro
Dari
paragraf sebelumnya, telah menjadi jelas bahwa proses nitrasi disertai
dengan panas. Dalam seri benzena toluena
parafin dan fenol, jelas bahwa semakin dekat kelompok intro adalah satu sama
lain dalam cincin benzena, semakin besar ketegangan dalam molekul dan bawah
panas pembentukan. Jadi o-dinitrobenzene dan orto-mononitro senyawa dari seri
toluena dan fenol memiliki terkecil kalor pembentukan. Perbedaan antara orto
dan para derivative terbesar untuk benzena
dan setidaknya untuk seri fenol. Dalam kasus turunannya trinitro, kedekatan
kelompok memiliki efek yang sama.
2.15. Proses
Peralatan Untuk Teknik Nitratsi
1. Jenis
peralatan proses
Nitrations,
sebagai proses industri teknis, telah berevolusi dari batch-jenis operasi
menggunakan kapal batuan dan operasi tangan menjadi mesin yang dapat dikontrol secara
otomatis terus-menerus. Tingginya memanaskan reaksi dan dilusi yang terlibat
dalam nitrasi, awalnya diserap dengan menempatkan kapal batu ware dalam bak
air, kini diambil oleh kumparan atau jaket didinginkan oleh air garam. Ide
remote control mengimbau kepada desainer peralatan untuk pembuatan. Setiap
jenis proses memiliki keunggulan khas sendiri.
Dalam
arti luas, proses batch memiliki keuntungan sebagai berikut dibandingkan dengan
proses yang kontinyu:
a. Fleksibilitas
Batch-peralatan
proses memiliki kegunaan umum karena setiap materi batch yang lewat melalui
proses yang terpisah, atau hampir terpisah. Hal ini biasanya lebih mudah untuk
memperkenalkan variasi proses ke proses batch daripada continue.
b. Buruh Penggunaan
Untuk tingginya tingkat
produksi ketika batch besar digunakan efisiensi tenaga kerja proses batch
mungkin sama baiknya seperti yang untuk proses yang berkesinambungan. Hal ini
tampaknya benar untuk produksi skala besar industri nitrogliserin dan
nitrotoluene misalnya.
Proses
yang kontinyu, secara umum, akan ditemukan memiliki beberapa keuntungan atas
proses batch:
a. Menurunkan biaya modal
Untuk
tingkat produksi tertentu, peralatan yang dibutuhkan untuk proses kontinyu
lebih kecil daripada untuk proses batch.
b. Keselamatan
Karena
peralatan proses kontinyu ukurannya yang relatif kecil
c. Buruh penggunaan
Dalam bidang nitrasi,
proses yang kontinyu adalah pengguna tenaga kerja lebih efisien daripada proses
batch.
2. Batch
Nitration
Nitrasi
biasanya dilakukan dalam wadah besi atau baja tertutup. Praktik modern yang
digunakan adalah baja karbon yang ringan. Ketika penitrasi dicampur dengan asam (nitrat-sulfat), masa pakai
nitrators tersebut baik, dan setiap kegagalan masanyaa yang singkat biasanya
dapat ditelusuri melalui air yang berlebihan atau nitrat kandungan asam rendah
yang terdapat dalam limbah asam. Secara umum, nitrator terdiri dari sebuah
kapal silinder tegak yang mengandung beberapa jenis permukaan pendinginan, alat
agitasi, inlet umpan atau inlet, dan lini produk outlet. Nitrators kebanyakan
juga dilengkapi dengan garis besar diammeter pembuangan yang cepat untuk
penggunaan darurat jika reaksi keluar atau suhu meningkat karena kegagalan
agitasi, pendinginan, atau sebaliknya. Dalam keadaan darurat tersebut, isi nitrator dapat dibuang dengan cepat ke
dalam volume besar air.
Dua
faktor utama yang dirancang penting dari nitrator adalah (1) agitasi derajat,
(2) kontrol suhu. Agitasi umumnya harus efisien, bahkan kekerasan, untuk
mendapatkan reaksi halus dan untuk menghindari overheating lokal yang bisa
terjadi jika tempat itu ada di nitrator tersebut. Pendinginan atau kontrol suhu
di nitrators umumnya dilakukan dengan gulungan tabung melalui baik air dingin
maupun air garam untuk pendinginan beredar atau air panas atau uap untuk
pemanasan. untuk kontrol untuk suhu di nitrations, jaket dinding biasanya tidak
cukup efisien kecuali dalam kasus kapal kapasitas sangat kecil. Kebutuhan untuk
permukaan pendinginan besar dan untuk kecepatan tinggi media pendingin dan isi
nitrator melewati permukaan menentukan penggunaan tabung pendingin.
Mungkin jenis yang paling
umum dari sistem mengagitasi digunakan dalam nitrators terdiri dari poros
vertikal dengan satu atau lebih baling-baling dipasang di atasnya. Ini poros
baling-baling dipasang di pusat berbentuk silinder dari satu atau lebih bank
koil pendingin. Sebuah lengan silinder yang sebenarnya di kadang-kadang
dipasang di tengah kumparan bank untuk memastikan sirkulasi isi nitrator adalah
sebuah diinginkan. Ketika pakan reaktan untuk nitrator adalah dari atas ke
tengah lengan pengaduk, sirkulasi oleh baling-baling biasanya turun melalui
pusat dan sekitar dan naik melalui kumparan pendingin. Ketika pakan adalah di
bawah tingkat cairan, di bagian bawah lengan, dan asam siklus digunakan,
sirkulasi mungkin atas melalui lengan dan sekitar dan turun melalui tepi
kumparan. Perpindahan panas yang baik pencampuran dan efisien diperoleh dengan
ini Ketika asam siklus tidak digunakan "pengaturan lengan-dan-baling.",
Sirkulasi turun melalui lengan sehingga umpan hidrokarbon ke dalam lengan dekat
bagian bawah dengan cepat tersebar dalam asam campuran dan segera melewati
kumparan pendingin.
3. Nitrasi
kontinyu
Yang
terkenal awal aplikasi prosedur kontinyu untuk nitrasi dari alkohol polihidrat
seperti gliserin dan hidrokarbon seperti benzena dibuat di Eropa. Metode yang
digunakan untuk produksi kontinyu yaitu produk yang likuid, dan karenanya dapat
dipisahkan dari cairan bercampur lain seperti menghabiskan asam penitrasi
dengan decanting prosedur, serta nitrations yang cepat dan tidak oleh karena
itu memerlukan waktu lama reaksi-tunjangan, yang pertama dikembangkan.
Kemudian, peralatan untuk proses yang lebih kompleks telah bekerja. Saat itu
aman untuk menganggap bahwa nitrations kebanyakan bisa ditangani oleh prosedur
kontinyu.
Reaksi
nitrasi yang sebenarnya dalam suatu proses kontinyu yang dilakukan dalam jenis
yang sama seperti yang digunakan untuk nitrations batch, dengan pengecualian
bahwa pipa overflow pengaturan penahan
disediakan untuk operasi kontinyu ditunjukkan pada Gambar. 4-9 dan 4-10.
Gambar 4-9 menunjukkan jenis nitrator dirancang untuk sistem Schmid-Meissner
Jerman. Dalam alat ini bahan yang akan nitrasi dimasukkan ke bagian atas
nitrator dan segera ditarik ke bawah melalui lengan dan intim dan dicampur
dengan asam dihabiskan dan bahan bereaksi. Di bagian bawah nitrator, asam
campuran segar makan dan immediatelymixed dengan reaktan lain dengan cara laju
aliran tinggi diinduksi oleh pengaduk dan baffle disediakan. Bahan bereaksi
kemudian lulus ke atas dengan kecepatan tinggi melalui tabung yang dikelilingi
oleh air garam didinginkan beredar di jaket. Produk dan asam menghabiskan
ditarik terus menerus dari nitrator melalui saluran meluap.
Keselamatan
tindakan yang harus hadir dalam operasi nitrasi serupa untuk proses baik terus
menerus dan batch. Hal ini umum untuk menyediakan otomatis menghentikan pakan
dari bahan yang akan nitrasi dalam hal kenaikan temperatur yang tidak
semestinya di nitrator tersebut, kegagalan sirkulasi pendingin atau air garam,
atau kegagalan agitasi. Hal ini umum untuk mensyaratkan bahwa pengamatan
terus-menerus suhu nitrator dipertahankan, pakan dari reaktan kemudian dapat
dengan mudah dikendalikan oleh katup "mati-aman" yang dapat tetap
terbuka hanya dengan tekanan manual. Solenoid-kontrol operasi yang
"gagal-aman" juga sering digunakan. Ungkapan "gagal-aman"
pada umumnya berarti bahwa operasi dapat dilakukan hanya bila semua layanan
yang diperlukan seperti listrik, pendingin, atau agitasi yang berfungsi.
Misalnya, dalam peralatan yang dirancang oleh Biazzi untuk nitrasi gliserin,
gliserin lengan-pakan dapat diselenggarakan di tempat, turun atas pembukaan
nitrator-pakan, hanya oleh aparat solenoid energi. Kegagalan daya listrik kemudian
menyebabkan kumparan solenoid akan deenergized, dan ketika hal ini terjadi
perubahan pakan lengan keluar dari tempat dan pakan gliserin terputus secara
otomatis.

4. Campuran
Untuk Nitrasi Asam
Untuk
memahami operasi dari pabrik nitrasi dengan lengkap, perlu untuk memahami
sesuatu dari pengolahan asam campuran biasanya digunakan, termasuk, penyesuaian
persiapan untuk kebutuhan nitrasi ini, penanganan menghabiskan asam, dan
pembuangan limbah pulih dari itu. Gambar berikut menunjukkan aliran asam dalam
operasi asam yang khas. Komposisi yang ditunjukkan adalah mereka untuk asam
campuran yang digunakan untuk memproduksi trinitrate gliseril. Ekonomi operasi
asam adalah sangat penting dalam biaya semua operasi dari proses nitrasi.

5. Pengolahan
asam
Materi
yang memasuki asam pengolahan 65 persen oleum dari kontak-proses tanaman
sulfat, 50-60 persen HNO3 dari pabrik ammonia-oksidasi, dan menghabiskan asam
dari operasi nitrasi. Pengolahan menghasilkan asam campuran nitrogliserin,
terkonsentrasi HNO3, dan 93 persen H2SO4. Biasanya 93 persen H2SO4 dihasilkan
harus dibuang oleh penjualan ke produsen pupuk, untuk asam pengguna teknis
untuk tujuan seperti asam logam atau, kadang-kadang, untuk produsen asam sulfat
digunakan dalam sistem penyerapan kontak-proses. Uraian singkat berikut akan
berfungsi untuk memberikan alasan untuk berbagai langkah yang ditunjukkan dalam
diagram Gambar. 4-11. Oleum 65 persen disimpan dalam sebuah bangunan dipanaskan
pada saat diterima oleh mobil tangki karena memiliki titik beku sekitar 41oF
(5oC) dan readly membeku selama cuaca dingin. Untuk menghindari
gangguan ini pembekuan, oleum kuat diencerkan dengan larutan yang disebut 40
persen oleum dan antibeku, dengan komposisi nominal sekitar 103 persen H2SO4, 6
persen HNO3 (dengan analisis volumetrik), yang solusi tetap cair baik melenguh
0oF9-18oC). Ini oleum 40 persen digunakan pertama untuk
campuran dengan 97 persen HNO3 untuk membuat asam semimix untuk membuat
penyesuaian akhir semimix tersebut, setelah analisis, dengan asam campuran yang
diinginkan siap untuk digunakan dalam nitrations. 97 persen HNO3 dibuat dalam
konsentrator makan dengan asam konsentrator campuran yang terbuat dari lemah,
(55-60 persen) HNO3, 93 persen H2SO4, dan menghabiskan penitrasi asam dengan
komposisi sekitar 35 persen H2SO4, 23 persen HNO3 . Asam campuran diumpankan ke
operasi denitrating dan berkonsentrasi.
Dalam
proses ini langkah pertama melibatkan makan asam encer ke puncak menara
dikemas. Sebagai asam menetes turun melalui menara, dipanaskan oleh uap naik
dari bawah. Ada cukup H2SO4 hadir untuk menahan air, dan HNO3 yang kuat bersama
dengan oksida nitrogen volatilized dan lulus dari atas menara untuk pemutihan
dan pembuluh penyerapan dimana oksida punya waktu untuk teroksidasi oleh udara
mengakui dan bentuk encer HNO3 para HNO3. kuat yang dihasilkan oleh kondensasi
uap awal dari menara akan dihapus pada operasi pemutihan. The HNO3 encer
dihasilkan dalam sistem penyerapan diumpankan kembali ke menara denitrating.
Produk lain dari operasi ini denitrating dan berkonsentrasi adalah asam sulfat
encer, diambil dari bagian bawah menara denitrating sekitar 70 persen kekuatan.
The H2SO4 encer ini kemudian dipekatkan dengan kekuatan 66oBe dalam
bahan bakar-bakar minyak Drum konsentrator.
Pemutih
dan penyerapan menara biasanya terbuat dari bahan keramik. Kecenderungan saat
ini adalah untuk menggantikan menara penyerapan keramik yang single-pass menara
logam, yang melibatkan beban pemeliharaan jauh lebih sedikit.


















0 comments:
Posting Komentar