Benda-banda yang ada di lingkungan sekitar kita seluruhnya mengandung unsur-unsur kimia. Buku yang kita baca, pulpen untuk menulis, jalan raya yang kita injak, pakaian dan sepatu yang kita kenakan, serta benda-benda lainnya mengandung unsur kimia. Tubuh kita pun mengandung unsur kimia. Setidaknya terdapat 26 unsur kimia dalam tubuh manusia.
Begitu juga dengan keadaan di alam. Contohnya air laut, air laut mengandung unsur Na dan Cl dalam bentuk senyawa NaCI. Udara yang kita hirup terdiri dari unsur O2. Bagian terkecil dari unsur kimia dinamakan atom. Atom tidak dapat dilihat oleh mata telanjang karena ukurannya yang demikian kecil. Pada blog ini, kita akan mempelajari struktur atom pengelompokan unsur-unsur kimia dalam suatu tabel periodik. Melalui tabel periodik tersebut, kita dapat mcngetahui sifat-sifat unsur dan sifat-sifat periodik suatu unsur.
A. Perkembangan Sistem Periodik
Unsur-unsur yang sudah ditemukan di alam banyak sekali. Setiap unsur mempunyai massa dan sifat yang berbeda. Namun, ada juga beberapa unsur yang mempunyai kemiripan sifat. Berdasarkan hal tersebut, para ilmuwan kimia mengelompokkan unsur-unsur kimia. Pengelompokan unsur-unsur bertujuan memudahkan penentuan sifat setiap unsur dalam membentuk suatu senyawa.
Unsur-unsur dikelompokkan berdasarkan kemiripan sifatnya. Penyusunan sistem periodik unsur telah mengalami penyempurnaan. Mulai dari Antonie Lavoiser, J. Newlands, D. Mendeleev, hingga Henry Moseley.
1. Pengelompokan Unsur menurut Lavoiser
Pada tahun 7789, Antonie Lavoiser mengelompokkan 33 unsur kimia. Lavoiser mengelompokkan unsur-unsur tersebut berdasarkan sifat kimianya. Unsur-unsur kimia dibagi menjadi empat kelompok, yaitu gas, tanah, logam dan non logam. Pengelompokan ini masih terlalu umum karena ternyata dalam kelompok unsur logam masih terdapat berbagai unsur logam yang memiliki sifat berbeda.
2. Hukum Triade Dobereiner
Pada tahun 1829, J.B. Dobereiner mengelompokkan unsur-unsur berdasarkan kemiripan sifat-sifat.
Tabel. Pengelompokan unsur-unsur menurut Hukum Triade Dobereiner
Dari pengelompokan unsur tersebut, terdapat suatu keteraturan. Setiap tiga unsur yang sifatnya mirip, massa atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata dari massa atom unsur pertama dan ketiga. Perhatikan contoh berikut:
3. Hukum Oktaf Newlands
J. Newlands merupakan orang pertama yang mengelompokkan unsur-unsur berdasarkan kenaikan massa atom relatif. Pada tahun 1863, ia menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Pada tabel berikut tersaji unsur-unsur yang disusun berdasarkan hukum oktaf Newlands.
Tabel. Unsur-unsur Oktaf Newlands
4. Hukum Mendeleev
Di antara para ahli yang dianggap paling berhasil dalam mengelompokkan unsur-unsur dan berani menduga adanya unsur-unsur yang pada saat itu belum ditemukan adalah Dmitri Mendeleev. Ia seorang ahli kimia berkebangsaan Rusia. pada tahun 1869, Mendeleev mengelompokkan unsur-unsur berdasarkan kenaikan massa atom relatifnya.
Cara mengelompokkan dilakukan dengan menggunakan kartu. Dalam kartu tersebut ditulis lambang atom, massa atom relatif, dan sifat-sifat unsur tersebut. Kemudian, unsur-unsur disusun berdasarkan kenaikan massa atom relatif dan sifat-sifatnya. Unsur-unsur yang memiliki sifat serupa ditempatkan pada lajur tegak (vertikal) yang disebut golongan.
Alternatif pengelompokan lebih ditekankan pada sifat-sifat kimia atom tersebut daripada kenaikan massa atom relatifnya. Akibatnya, ada tempat-tempat kosong dalam tabel periodik tersebut. Tempat-tempat kosong inilah yang oleh Mendeleev diduga akan diisi unsur-unsur yang ketika itu belum ditemukan. Ternyata, dugaan itu terbukti dengan ditemukannya unsur-unsur yang memiliki sifat yang mirip.
Tabel. Pengelompokan Unsur Mendeleev
Pada waktu yang hampir bersamaan, Lothar Meyer melakukan hal yang mirip dengan Mendeleev. Ilmuwan kimia Jerman tersebut menyusun 57 unsur kimia berdasarkan kenaikan massa atom. Yang membedakan dengan Mendeleev, Meyer mengelompokkannya dengan menekankan pada sifat fisika unsur. Adapun Mendeleev sesuai sifat kimia unsur. Sistem periodik Meyer tersebut disusun pada tahun 1868, namun baru dipublikasikan pada tahun 1870.
Dasar Pengelompokan Unsur
5. Sistem Periodik Modern
Pada tahun 1913, Henry Moseley melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar X.
Hasil eksperimen kimiawan Inggris tersebut menyimpulkan bahwa sifat dasar atom bukanlah didasari oleh massa atom relatif, melainkan berdasarkan kenaikan jumlah proton. Hal tersebut diakibatkan adanya unsur-unsur yang memiliki massa atom berbeda, tetapi memiliki jumlah proton yang sama atau disebut isotop.
Kenaikan jumlah proton ini mencerminkan kenaikan nomor atom unsur tersebut. Pengelompokan unsur-unsur sistem periodik modern merupakan penyempurnaan hukum periodik Mendeleev, yang disebut juga sistem periodik bentuk panjang.
B. Susunan Unsur dalam Sistem Periodik Modern
Unsur-unsur dalam sistem periodik modern (bentuk panjang) dikelompokkan ke dalam golongan dan periode. Terdapat dua cara penamaan golongan unsur dalam sistem periodik modern, yaitu cara tradisional dan cara IUPAC.
1. Golongan
Golongan ditempatkan pada lajur vertikal dalam sistem periodik modern. Penentuan golongan berkaitan dengan sifat-sifat yang dimiliki unsur tersebut. Unsur-unsur dalam satu golongan memiliki sifat-sifat yang mirip. Beberapa golongan diberi nama khusus, yaitu:
2. Periode
Periode ditempatkan pada lajur horizontal dalam sistem periodik modern. Periode suatu unsur menunjukkan nomor kulit yang sudah terisi elektron (n terbesar) berdasarkan konfigurasi elektron.
Dalam sistem periodik modern terdapat 7 periode, yaitu:
C. Struktur Atom
Pada tahun 1808, John Dalton menyatakan bahwa atom adalah partikel terkecil yang tidak dapat dibagi-bagi lagi. Teori atom Dalton bertahan hingga ditemukannya keradioaktifan pada tahun 1896. penelitian keradioaktifan yang dilakukan J.J. Thompson, Ernest Rutherford Roberd Millikan, dan James Chadwick membuka jalan ditemukannya partikel dasar penyusunan atom. Ukuran isi atom sangat kecil sehingga teknologi saat ini belum dapat mengamati isi atom yang sesungguhnya. Yang dapat diamati hanyalah gejala-gejala yang timbul akibat keberadaannya.
1. Partikel Dasar Penyusun Atom
Suatu atom tersusun proton, neutron, dan elektron. Proton dan neutron terletak di inti atom, sedangkan elektron bergerak mengelilingi atom.
a. Elektron
Partikel dalam atom kali pertama ditemukan oleh fisikawan Inggris, Joseph J. Thompson pada tahun 1897. Eksperimen yang dilakukannya menggunakan dua pelat logam sebagai elektrode dalam tabung kaca vakum. Kedua elektron tersebut dihubungkan dengan sumber arus bertegangan tinggi.
Hasil eksperimen menunjukkan adanya sinar yang keluar dari elektroda negatif (katode) menuju elektrode positif (anode). Sinar yang keluar dari katode disebut sinar katode, sedangkan tabung vakumnya disebut tabung sinar katode. Sinar ini tidak terlihat oleh mata, tetapi dapat memendarkan zat tertentu sehingga dapat terlacak keberadaannya.
Thompson menemukan bahwa medan magnet dan medan listrik mempengaruhi sinar katode. Ketika magnet didekatkan pada tabung, arah sinar katode berbelok. Sementara itu, kutub positif medan listrik menarik sinar katode sedangkan kutub negatif menolaknya.
Dengan dibelokkannya sinar katode menuju kutub positif, Thompson menyimpulkan bahwa sinar katode bukanlah gelombang. Menurut Thompson, sinar katode merupakan arus partikel yang memiliki massa, dan bermuatan negatif. Partikel tersebut dinamakan elektron. Thomson juga berhasil menentukan perbandingan harga muatan negatif elektron terhadap massanya, yaitu
Begitu juga dengan keadaan di alam. Contohnya air laut, air laut mengandung unsur Na dan Cl dalam bentuk senyawa NaCI. Udara yang kita hirup terdiri dari unsur O2. Bagian terkecil dari unsur kimia dinamakan atom. Atom tidak dapat dilihat oleh mata telanjang karena ukurannya yang demikian kecil. Pada blog ini, kita akan mempelajari struktur atom pengelompokan unsur-unsur kimia dalam suatu tabel periodik. Melalui tabel periodik tersebut, kita dapat mcngetahui sifat-sifat unsur dan sifat-sifat periodik suatu unsur.
A. Perkembangan Sistem Periodik
Unsur-unsur yang sudah ditemukan di alam banyak sekali. Setiap unsur mempunyai massa dan sifat yang berbeda. Namun, ada juga beberapa unsur yang mempunyai kemiripan sifat. Berdasarkan hal tersebut, para ilmuwan kimia mengelompokkan unsur-unsur kimia. Pengelompokan unsur-unsur bertujuan memudahkan penentuan sifat setiap unsur dalam membentuk suatu senyawa.
Unsur-unsur dikelompokkan berdasarkan kemiripan sifatnya. Penyusunan sistem periodik unsur telah mengalami penyempurnaan. Mulai dari Antonie Lavoiser, J. Newlands, D. Mendeleev, hingga Henry Moseley.
1. Pengelompokan Unsur menurut Lavoiser
Pada tahun 7789, Antonie Lavoiser mengelompokkan 33 unsur kimia. Lavoiser mengelompokkan unsur-unsur tersebut berdasarkan sifat kimianya. Unsur-unsur kimia dibagi menjadi empat kelompok, yaitu gas, tanah, logam dan non logam. Pengelompokan ini masih terlalu umum karena ternyata dalam kelompok unsur logam masih terdapat berbagai unsur logam yang memiliki sifat berbeda.
2. Hukum Triade Dobereiner
Pada tahun 1829, J.B. Dobereiner mengelompokkan unsur-unsur berdasarkan kemiripan sifat-sifat.
Tabel. Pengelompokan unsur-unsur menurut Hukum Triade Dobereiner
Dari pengelompokan unsur tersebut, terdapat suatu keteraturan. Setiap tiga unsur yang sifatnya mirip, massa atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata dari massa atom unsur pertama dan ketiga. Perhatikan contoh berikut:
3. Hukum Oktaf Newlands
J. Newlands merupakan orang pertama yang mengelompokkan unsur-unsur berdasarkan kenaikan massa atom relatif. Pada tahun 1863, ia menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Pada tabel berikut tersaji unsur-unsur yang disusun berdasarkan hukum oktaf Newlands.
Tabel. Unsur-unsur Oktaf Newlands
4. Hukum Mendeleev
Di antara para ahli yang dianggap paling berhasil dalam mengelompokkan unsur-unsur dan berani menduga adanya unsur-unsur yang pada saat itu belum ditemukan adalah Dmitri Mendeleev. Ia seorang ahli kimia berkebangsaan Rusia. pada tahun 1869, Mendeleev mengelompokkan unsur-unsur berdasarkan kenaikan massa atom relatifnya.
Cara mengelompokkan dilakukan dengan menggunakan kartu. Dalam kartu tersebut ditulis lambang atom, massa atom relatif, dan sifat-sifat unsur tersebut. Kemudian, unsur-unsur disusun berdasarkan kenaikan massa atom relatif dan sifat-sifatnya. Unsur-unsur yang memiliki sifat serupa ditempatkan pada lajur tegak (vertikal) yang disebut golongan.
Alternatif pengelompokan lebih ditekankan pada sifat-sifat kimia atom tersebut daripada kenaikan massa atom relatifnya. Akibatnya, ada tempat-tempat kosong dalam tabel periodik tersebut. Tempat-tempat kosong inilah yang oleh Mendeleev diduga akan diisi unsur-unsur yang ketika itu belum ditemukan. Ternyata, dugaan itu terbukti dengan ditemukannya unsur-unsur yang memiliki sifat yang mirip.
Tabel. Pengelompokan Unsur Mendeleev
Pada waktu yang hampir bersamaan, Lothar Meyer melakukan hal yang mirip dengan Mendeleev. Ilmuwan kimia Jerman tersebut menyusun 57 unsur kimia berdasarkan kenaikan massa atom. Yang membedakan dengan Mendeleev, Meyer mengelompokkannya dengan menekankan pada sifat fisika unsur. Adapun Mendeleev sesuai sifat kimia unsur. Sistem periodik Meyer tersebut disusun pada tahun 1868, namun baru dipublikasikan pada tahun 1870.
Dasar Pengelompokan Unsur
5. Sistem Periodik Modern
Pada tahun 1913, Henry Moseley melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar X.
Hasil eksperimen kimiawan Inggris tersebut menyimpulkan bahwa sifat dasar atom bukanlah didasari oleh massa atom relatif, melainkan berdasarkan kenaikan jumlah proton. Hal tersebut diakibatkan adanya unsur-unsur yang memiliki massa atom berbeda, tetapi memiliki jumlah proton yang sama atau disebut isotop.
Kenaikan jumlah proton ini mencerminkan kenaikan nomor atom unsur tersebut. Pengelompokan unsur-unsur sistem periodik modern merupakan penyempurnaan hukum periodik Mendeleev, yang disebut juga sistem periodik bentuk panjang.
B. Susunan Unsur dalam Sistem Periodik Modern
Unsur-unsur dalam sistem periodik modern (bentuk panjang) dikelompokkan ke dalam golongan dan periode. Terdapat dua cara penamaan golongan unsur dalam sistem periodik modern, yaitu cara tradisional dan cara IUPAC.
1. Golongan
Golongan ditempatkan pada lajur vertikal dalam sistem periodik modern. Penentuan golongan berkaitan dengan sifat-sifat yang dimiliki unsur tersebut. Unsur-unsur dalam satu golongan memiliki sifat-sifat yang mirip. Beberapa golongan diberi nama khusus, yaitu:
- golongan IA (kecuali H) disebut golongan alkali;
- golongan IIA disebut golongan alkali tanah;
- golongan VIIA disebut golongan halogen;
- golongan VIIIA disebut golongan gas mulia;
- golongan IIIA, IVA, VA, dan VIA disebut sesuai dengan unsur yang terdapat dalam golongan tersebut, yaitu:
- golongan IIIA disebut golongan boron-alumunium;
- golongan IVA disebut golongan karbonsilikon;
- golongan VA disebt golongan nitrogen-fosforus;
- golongan VIA disebut golongan oksigenbelerang;
2. Periode
Periode ditempatkan pada lajur horizontal dalam sistem periodik modern. Periode suatu unsur menunjukkan nomor kulit yang sudah terisi elektron (n terbesar) berdasarkan konfigurasi elektron.
Dalam sistem periodik modern terdapat 7 periode, yaitu:
Periode 1 : terdiri atas 2 unsur
Periode 2 : terdiri atas 8 unsur
Periode 3 : terdiri atas 8 unsur
Periode 4 : terdiri atas 18 unsur
Periode 5 : terdiri atas 18 unsur
Periode 6 : terdiri atas 32 unsur, yaitu 18 unsur seperti periode 4 atau 5, dan 14 unsur lagi merupakan deret lantanida;
Periode 7 : merupakan periode unsur yang belum lengkap. Pada periode ini terdapat deret aktinida.
Pada tahun 1808, John Dalton menyatakan bahwa atom adalah partikel terkecil yang tidak dapat dibagi-bagi lagi. Teori atom Dalton bertahan hingga ditemukannya keradioaktifan pada tahun 1896. penelitian keradioaktifan yang dilakukan J.J. Thompson, Ernest Rutherford Roberd Millikan, dan James Chadwick membuka jalan ditemukannya partikel dasar penyusunan atom. Ukuran isi atom sangat kecil sehingga teknologi saat ini belum dapat mengamati isi atom yang sesungguhnya. Yang dapat diamati hanyalah gejala-gejala yang timbul akibat keberadaannya.
1. Partikel Dasar Penyusun Atom
Suatu atom tersusun proton, neutron, dan elektron. Proton dan neutron terletak di inti atom, sedangkan elektron bergerak mengelilingi atom.
a. Elektron
Partikel dalam atom kali pertama ditemukan oleh fisikawan Inggris, Joseph J. Thompson pada tahun 1897. Eksperimen yang dilakukannya menggunakan dua pelat logam sebagai elektrode dalam tabung kaca vakum. Kedua elektron tersebut dihubungkan dengan sumber arus bertegangan tinggi.
Hasil eksperimen menunjukkan adanya sinar yang keluar dari elektroda negatif (katode) menuju elektrode positif (anode). Sinar yang keluar dari katode disebut sinar katode, sedangkan tabung vakumnya disebut tabung sinar katode. Sinar ini tidak terlihat oleh mata, tetapi dapat memendarkan zat tertentu sehingga dapat terlacak keberadaannya.
Thompson menemukan bahwa medan magnet dan medan listrik mempengaruhi sinar katode. Ketika magnet didekatkan pada tabung, arah sinar katode berbelok. Sementara itu, kutub positif medan listrik menarik sinar katode sedangkan kutub negatif menolaknya.
Dengan dibelokkannya sinar katode menuju kutub positif, Thompson menyimpulkan bahwa sinar katode bukanlah gelombang. Menurut Thompson, sinar katode merupakan arus partikel yang memiliki massa, dan bermuatan negatif. Partikel tersebut dinamakan elektron. Thomson juga berhasil menentukan perbandingan harga muatan negatif elektron terhadap massanya, yaitu
e/m = -1,76 x 108 coulomb/gram
e = muatan elektron dalam satuan coulomb
m = massa elektron dalam satuan gram
Pada tahun 1909, Robert Millikan berhasil menentukan muatan elektron melalui eksperimen tetesan minyak. Dalam eksperimen ini, Robert Millikan mengamati bahwa setiap tetesan halus minyak selalu memiliki muatan berupa kelipatan -1,6x10-19 coulomb. Millikan menduga bahwa setiap tetesan minyak menangkap elektron dengan jumlah satu, dua, tiga, dan seterusnya. Kemudian, Millikan menyimpulkan bahwa elektron bermuatan -1,6x10-19 coulomb. Data ini kemudian dipadukan dengan penemuan Thomson sehingga massa elektron dapat ditentukan, yaitu
e/m = -1,76 x 108 coulomb/gram, dan
e = -1,6x10-19 coulomb
Berdasarkan hasil perhitungan tersebut diperoleh massa elektron sebagai berikut
m = (-1,6x10-19 coulomb) / (-1,76 x 108 coulomb/gram)
m = 9,11 x 10-28 gram
Jadi elektron merupakan partikel sub-atom (bagian dari atom) dengan massa 9,11 x 10-28 gram dan bermuatan -1,6x10-19 coulomb. Penemuan elektron ini menimbulkan pertanyaan baru, bukankah sebuah atom bermuatan netral? Adakah partikel lain yang mempunyai muatan berlawanan dengan elektron?
b. Proton
Pada tahun-tahun pergantian abad itu, berkembang pula penelitian mengenai sinar radioaktif. Di antara radiasi yang dikenal adalah sinar alfa (a). Sinar a merupakan partikel yang bermassa 4 sma (7.000 x massa elektron) dan bermuatan +3,2 x 10-19 coulomb (-2 x muatan elektron namun berlawanan tanda). Sinar a inilah yang digunakan oleh Ernest Rutherford untuk menemukan inti atom pada tahun 1911. Kelompok riset Rutherford melakukan percobaan dengan lempeng emas dan sinar a. Usaha Penemuan partikel bermuatan positif dalam atom mulai menunjukkan hasil.
Sinar alfa yang bermuatan positif dipancarkan oleh unsur radioaktif dan diarahkan pada lempengan tipis logam emas. Ternyata, sinar alfa ini dapat menembus lempengan tipis logam tersebut dan hanya sebagian kecil (1 dari 20.000 partikel) yang dibelokkan atau dipantulkan. Hasil ini berbeda dengan dugaan awal. Semula partikel sinar a akan diserap, dihamburkan, dipantulkan, dan juga diteruskan.
Setahun kemudian, barulah Rutherford menemukan penjelasan atas fenomena tersebut. Dia mengajukan keterangan bahwa atom merupakan ruang kosong. Seluruh muatan positif berkumpul pada sebuah titik yang disebut inti atom. pada perkembangan berikutnya, diketahui bahwa inti atom memiliki diameter inti = 10-13 cm, sedangkan diameter atomnya sendiri = 10-8 cm. Sebagai perbandingan, seandainya atom sebesar Gelora Bung Karno, inti atom merupakan sebutir kelereng yang diletakkan di tengah-tengahnya.
Jenis muatan inti atom sama dengan muatan sinar alfa (ditunjukkan oleh adanya pembelokan dan penolakan sinar a), yaitu muatan positif yang disebut proton. Kemudian, Rutherford menetapkan massa muatan positif inti atom. Ternyata, massa proton lebih kecil dibandingkan massa inti atom. pada tahun 1920, Rutherford mengajukan hipotesis, bahwa dalam inti atom ada partikel lain yang tidak bermuatan.
c. Neutron
Pada tahun 1932, dua belas tahun setelah hipotesis Rutherford, James Chadwick melakukan percobaan penembakan atom berilium dengan sinar alfa. percobaan ini menghasilkan penemuan partikel tidak bermuatan, yang disebut neutron. partikel neutron memiliki massa yang hampir sama dengan partikel proton, yaitu 1.836 kali massa elektron. Dalam perhitungan yang tidak memerlukan ketelitian tinggi, massa proton dan neutron dapat dianggap sama, yakni 7,67 x 10-24 gram atau 1 sma. Elektron memiliki massa 1/1.836 kali massa proton. Oleh karena bernilai sangat kecil, massa elektron dapat diabaikan terhadap massa proton atau dianggap sama dengan nol. Muatan elektron dinyatakan dengan -1 sehingga muatan proton adalah +1 dan muatan neutron adalah 0.
Tabel. Muatan dan Massa Partikel Penyusun Atom
2. Nomor Atom dan Nomor Massa
a. Nomor atom
Nomor atom suatu unsur menunjukkan jumlah proton yang terdapat dalam atom. Nomor atom (disingkat NA) diberi lambang Z. Nomor atom suatu unsur merupakan ciri khas atom unsur tersebut. Dari
nomor atom ini kita bisa menentukan konfigurasi elektron, nomor golongan, dan nomor periode suatu unsur (posisi unsur) dalam tabel sistem periodik unsur. Untuk atom netral, jumlah proton selalu sama dengan jumlah elektron. Dengan demikian, hubungan antara nomor atom, proton dan elektron dituliskan sebagai berikut:
Nomor atom = Z = NA = jumlah proton = jumlah elektron
Atom oksigen bernomor atom 8, berarti memiliki 8 proton dan 8 elektron. Atom neon bernomor atom 10, artinya neon memiliki 10 proton dan 10 elektron. Jadi, jika nomor atom berbeda, unsurnya juga berbeda.
b. Nomor Massa
Nomor massa menyatakan inti atom suatu unsur.
Nomor massa = A = jumlah proton + jumlah neutron
Jumlah proton ∑p = Z = NA,
Jumlah neutron ∑n
Sehingga:
Dengan mencantumkan nomor atom dan nomor massa, suatu atom dapat ditulis dengan notasi sebagai berikut:
Jadi, A adalah nomor massa yang ditulis di kiri atas (superskrip) dan Z adalah nomor atom yang ditulis di kiri bawah (subskrip).
Contoh :
3. Ion
Ion adalah atom yang melepas atau menangkap elektron. Pada atom netral, elektron dan proton akan saling berpasangan (jumlah proton = elektron). Jenis ion ada 2 sebagai berikut:
a. Ion positif
Ion positif adalah ion yang terbentuk dari atom yang kekurangan elektron.
b. Ion negatif
Ion negatif adalah ion yang terbentuk dari atom yang kelebihan elektron.
Contoh :
4. Isotop, Isobar dan Isoton
a. Isotop
Isotop adalah atom-atom yang memiliki nomor atom sama, tetapi nomor massanya berbeda. Nomor atom ditentukan oleh jumlah proton. Jumlah proton dalam isotop adalah sama, yang berbeda hanyalah jumlah neutronnya. Perhatikan contoh isotop karbon berikut ini:
Isotop-isotop tersebut, C-72, C-13, dan C-14, ketiganya merupakan atom karbon. Sifat-sifat kimianya identik. Sifat kimia tersebut ditentukan oleh jumlah elektron dan jumlah elektron dalam atom sama dengan jumlah protonnya.
Perbedaan isotop-isotop ini terletak pada sifat fisikanya, seperti massa. Isotop C-13 memiliki massa atom relatif 13 sma, lebih berat daripada C-72 yang massa atom relatifnya 12 sma. Selain itu, juga terdapat isotop yang bersifat radioaktif, misalnya isotop C-14.
Unsur-unsur di alam merupakan campuran dari isotop-isotopnya. Biasanya terdapat satu isotop yang dominan, misalnya untuk karbon, C-72 adalah isotop yang dominan kelimpahannya. Contoh isotop-isotop yang lain, yaitu:
Saat ini, isotop banyak digunakan dalam berbagai
bidang. Misalnya, penelitian industri dan kedokteran.
Berikut ini beberapa isotop yang sering digunakan.
Atom hidrogen mempunyai dua isotop yang penting, yaitu deuterium (21H) dan tritium (31H). Deuterium dapat diperoleh dengan mudah dari air laut. Adapun tritium dapat diperoleh dari sintesis deuterium. Deuterium maupun tritium digunakan sebagai bahan bakar reaksi fusi nuklir.
Karbon -14 (C-14) merupakan isotop karbon yang paling banyak digunakan dalam berbagai bidang C-14 digunakan sebagai perunut dalam penelitian di bidang biokimia kedokteran dan sumber radiasi, selain itu, C-14 digunakan sebagai alat untuk menentukan umur benda arkeologi dan geologi. Kobalt -60 (Co -60) digunakan dalam bidang kesehatan.
b. Isobar
Isobar adalah atom-atom yang memiliki nomor massa sama, tetapi nomor atom berbeda. Contoh:
147N dan 146C memiliki nomor massa 14, dan
2411Na dan 2412Mg memiliki nomor massa 24
Sifat kimia setiap isobar sangat berbeda karena unsurnya memang berbeda. Satu-satunya kesamaan isobar adalah massanya sehingga spektrometri massa tidak dapat membedakannya.
c. Isoton
Isoton adalah atom-atom yang memiliki jumlah neutron sama, tetapi jumlah protonnya berbeda. Contoh:
136C dan 147N memiliki 7 neutron, dan
3115P dan 3216S memiliki 16 neutron.
Isoton-isoton memiliki massa dan sifat yang berbeda.
5. Konfigurasi Elektron dan Elektron Valensi
Elektron merupakan partikel atom yang sangat ringan sehingga massanya dapat diabaikan dan dianggap sama dengan nol. Dalam suatu atom, jumlah elektron sama dengan jumlah proton, tetapi jenis muatannya berlawanan. Letak elektron berada di luar inti, yaitu terdapat di dalam lintasan-lintasan elektron.
Menurut Teori Atom Bohr, elektron berada dalam suatu lintasan atau orbit tertentu yang disebut lintasan elektron atau kulit elektron (shell electron). Setiap kulit memiliki tingkat energi tertentu. Semakin dekat ke inti atom, tingkat energi semakin kecil. Sebaliknya, semakin jauh dari inti atom, tingkat energi semakin kecil. Sebaliknya, semakin jauh dari inti atom, tingkat energi semakin besar.
Berdasarkan hal tersebut urutan tingkat energi dapat dituliskan sebagai berikut:
a. Konfigurasi elektron
Konfigurasi elektron adalah susunan elektron yang bergerak pada lintasan tertentu yang disebut kulit atom. Elektron dalam atom tersusun berdasarkan tingkat energinya. Konfigurasi elektron per kulit didasarkan pada jumlah elektron maksimum yang dapat mengisi setiap kulit sesuai dengan rumusan.
Tabel. Jumlah Elektron Maksimum di Setiap Kulit
Urutan pengisian elektron dimulai dari kulit yang memiliki tingkat energi terendah, kemudian kulit berikutnya yang memiliki energi lebih tinggi, sampai pada kulit terakhir yang akan ditempati oleh elektron sisa.
Tabel. Konfigurasi Elektron Atom Berkulit K Sampai N
Atom hidrogen mempunyai dua isotop yang penting, yaitu deuterium (21H) dan tritium (31H). Deuterium dapat diperoleh dengan mudah dari air laut. Adapun tritium dapat diperoleh dari sintesis deuterium. Deuterium maupun tritium digunakan sebagai bahan bakar reaksi fusi nuklir.
Karbon -14 (C-14) merupakan isotop karbon yang paling banyak digunakan dalam berbagai bidang C-14 digunakan sebagai perunut dalam penelitian di bidang biokimia kedokteran dan sumber radiasi, selain itu, C-14 digunakan sebagai alat untuk menentukan umur benda arkeologi dan geologi. Kobalt -60 (Co -60) digunakan dalam bidang kesehatan.
b. Isobar
Isobar adalah atom-atom yang memiliki nomor massa sama, tetapi nomor atom berbeda. Contoh:
147N dan 146C memiliki nomor massa 14, dan
2411Na dan 2412Mg memiliki nomor massa 24
Sifat kimia setiap isobar sangat berbeda karena unsurnya memang berbeda. Satu-satunya kesamaan isobar adalah massanya sehingga spektrometri massa tidak dapat membedakannya.
c. Isoton
Isoton adalah atom-atom yang memiliki jumlah neutron sama, tetapi jumlah protonnya berbeda. Contoh:
136C dan 147N memiliki 7 neutron, dan
3115P dan 3216S memiliki 16 neutron.
Isoton-isoton memiliki massa dan sifat yang berbeda.
5. Konfigurasi Elektron dan Elektron Valensi
Elektron merupakan partikel atom yang sangat ringan sehingga massanya dapat diabaikan dan dianggap sama dengan nol. Dalam suatu atom, jumlah elektron sama dengan jumlah proton, tetapi jenis muatannya berlawanan. Letak elektron berada di luar inti, yaitu terdapat di dalam lintasan-lintasan elektron.
Menurut Teori Atom Bohr, elektron berada dalam suatu lintasan atau orbit tertentu yang disebut lintasan elektron atau kulit elektron (shell electron). Setiap kulit memiliki tingkat energi tertentu. Semakin dekat ke inti atom, tingkat energi semakin kecil. Sebaliknya, semakin jauh dari inti atom, tingkat energi semakin kecil. Sebaliknya, semakin jauh dari inti atom, tingkat energi semakin besar.
- Kulit ke-1 atau kulit K
- Kulit ke-2 atau kulit L
- Kulit ke-3 atau kulit M
- Kulit ke-4 atau kulit N
- Kulit ke-S atau kulit O
- Kulit ke-6 atau kulit P
- Kulit ke-7 atau kulit Q
Berdasarkan hal tersebut urutan tingkat energi dapat dituliskan sebagai berikut:
a. Konfigurasi elektron
Konfigurasi elektron adalah susunan elektron yang bergerak pada lintasan tertentu yang disebut kulit atom. Elektron dalam atom tersusun berdasarkan tingkat energinya. Konfigurasi elektron per kulit didasarkan pada jumlah elektron maksimum yang dapat mengisi setiap kulit sesuai dengan rumusan.
Tabel. Jumlah Elektron Maksimum di Setiap Kulit
Kulit
|
n
|
Ớ e maksimum
|
K
|
1
|
2 (1)2 = 2
|
L
|
2
|
2 (2)2 = 8
|
M
|
3
|
2 (3)2 = 18
|
N
|
4
|
2 (4)2 = 32
|
Urutan pengisian elektron dimulai dari kulit yang memiliki tingkat energi terendah, kemudian kulit berikutnya yang memiliki energi lebih tinggi, sampai pada kulit terakhir yang akan ditempati oleh elektron sisa.
Tabel. Konfigurasi Elektron Atom Berkulit K Sampai N
Atom
|
Jumlah
Elektron
|
Kulit K
(n = 1)
|
Kulit L
(n = 2)
|
Kulit M
(n = 3)
|
Kulit N
(n = 4)
|
1H
|
1
|
1
|
-
|
-
|
-
|
3Li
|
3
|
2
|
1
|
-
|
-
|
6C
|
6
|
2
|
4
|
-
|
-
|
12Mg
|
12
|
2
|
8
|
2
|
-
|
33As
|
33
|
2
|
8
|
18
|
5
|
Contoh :
3517Cl konfigurasi elektronnya = 2 8 7
Elektron valensinya = 7 (unsur golongan VII A)
Bagaimana jika jumlah elektron yang tersedia
tidak .mencapai jumlah elektron maksimum dalam
suatu kulit, bahkan lebih besar dari jumlah elektron
maksimum kulit sebelumnya? Jika demikian, kulit
yang akan ditempati elektron hanya menggunakan
jumlah elektron yang sama dengan jumlah elektron
maksimum dalam kulit sebelumnya. Hal tersebut
dapat digambarkan dengan bagan sebagai berikut:
Tabel. Konfigurasi Elektron Atom Berkulit M Sampai Q
Atom
|
Jumlah
Elektron
|
Kulit
K
(n=1)
|
Kulit
L
(n=2)
|
Kulit
M
(n=3)
|
Kulit
N
(n=4)
|
Kulit
O
(n=5)
|
Kulit
P
(n=6)
|
Kulit
Q
(n=7)
|
18Ar
|
18
|
2
|
8
|
8
|
||||
19K
|
19
|
2
|
8
|
8
|
1
|
|||
36Kr
|
36
|
2
|
8
|
18
|
8
|
|||
38Sr
|
38
|
2
|
8
|
18
|
8
|
2
|
||
52Te
|
52
|
2
|
8
|
18
|
18
|
6
|
||
54Xe
|
54
|
2
|
8
|
18
|
18
|
8
|
||
56Ba
|
56
|
2
|
8
|
18
|
18
|
8
|
2
|
|
83Bi
|
83
|
2
|
8
|
18
|
32
|
18
|
5
|
|
86Rn
|
86
|
2
|
8
|
18
|
32
|
18
|
8
|
|
88Ra
|
88
|
2
|
8
|
18
|
32
|
18
|
8
|
2
|
Cara konfigurasi elektron tersebut hanya berlaku
untuk atom unsur golongan utama (golongan A).
Adapun untuk atom unsur golongan transisi (golongan
B) harus menggunakan cara per subkulit.
Contoh pada tabel berikut memberikan gambaran
cara pengisian elektron dalam atom unsur golongan
transisi.
Tabel. Konfigurasi Elektron Atom Unsur Transisi
b. Elektron Valensi
Elektron valensi merupakan elektron yang terletak
pada kulit terluar sehingga memiliki tingkat energi
paling tinggi. Elektron valensi inilah yang berperan
dalam reaksi kimia. Elektron kulit terluar ini dapat
lepas, dipertukarkan, atau dipakai bersama dengan
atom lain membentuk ikatan antar-atom. Dengan kata
lain, sifat kimia atom ditentukan oleh elektron valensinya.
Bagaimanakah cara menenfukan elektron valensi?
Elektron valensi dapat ditentukan dengan dua cara,
yaitu menentukan konfigurasi elektron dan menggunakan
tabel periodik.
1) Penentuan elektron valensi dari konfigurasi elektron
Dengan menentukan konfigurasi elektronnya,
Anda dapat mengetahui jumlah elektron ada kulit
terluarnya. Agar Anda lebih memahami penentuan
elektron valensi dengan cara menentukan
konfigurasi elektronnya.
Tabel. Elektron Valensi Beberapa Atom
2) Penentuan elektron valensi menggunakan tabel periodik
Elektron valensi dapat juga ditentukan menggunakan
tabel periodik dengan melihat unsur
elektronnya. Berdasarkan struktur elektron, Anda
dapat mengetahui nomor kulit, jumlah elektron,
dan sub kulit. Contoh:
Ada beberapa bentuk penulisan struktur elektron
dalam tabel periodik. Perhatikan contoh-contoh
berikut!
Elektron valensi adalah jumlah elektron pada
kulit terluar pada struktur elektron nitrogen, jumlah elektron pada kulit terluar (kulit 2) adalah
5 elektron. Jadi, nitrogen mempunyai eiektron
valensi = 5.
b) Silikon : (Ne) 3s2 3p2
Struktur elektron silikon ditulis dengan cara
disingkat. Hal ini memudahkan dalam menentukan
elektron valensinya. Jumlah elektron
yang terletak di 3s dan 3p merupakan elektron
valensi. Jadi, elektron valensi silikon = 2 + 2 = 4
c) Vanadium : (Ar) 3d2 4s2
Elektron valensi vanadium terletak pada kulit
yang berbeda (bukan kulit terluar), yaitu pada
kulit ketiga (3d) dan kulit keempat (4s). Jadi,
jumlah elektron valensi vanadium = 3 + 2 = 5
d) Seng : (Ar) 3d10 4s2
Elektron valensi seng hanya terletak pada 4s.
Pada 3d, elektronnya berisi 10 elektron yang
berarti telah terisi penuh. Jumlah elektron pada
3d tidak dihitung sebagai elektron valensi.
Jadi, elektron valensi seng = 2. Vanadium dan
seng termasuk golongan transisi. Penentuan
elektron valensi golongan transisi akan dipelajari
lebih lanjut di kelas II.
c. Hubungan Golongan, Periode, Konfigurasi Elektron dan Elektron Valensi
Golongan suatu unsur menunjukkan jumlah elektron
valensi. Adapun periode suatu unsur menunjukkan
jumlah kulit yang telah terisi elektron. Elektron valensi dan jumlah kulit yang telah terisi elektron
dapat diketahui dari konfigurasi elektron. Jadi, dari
konfigurasi elektron dapat diketahui nomor golongan
dan periode suatu unsur.
D. Sifat-Sifat Unsur dan Massa Atom Relatif
1. Sifat Logam dan Non Logam
Sifat logam dan non logam dipengaruhi oleh elektron
valensi. Sifat logam berhubungan dengan kemampuan
suatu atom melepas elektron atau menjadi
bermuatan positif. Adapun sifat non logam berhubungan
dengan kecenderungan suatu atom untuk menerima
elektron atau menjadi bermuatan negatif.
Dalam sistem periodik, dari bawah ke atas dan
dari kiri ke kanan, sifat-sifat logam unsur semakin
berkurang dan sifat nonlogam semakin bertambah.
Natrium, magnesium, besi, tembaga, seng, alumunium,
perak dan emas termasuk unsur-unsur logam.
Adapun arang (karbon), iodium, hidrogen, dan oksigen
termasuk unsur-unsur nonlogam.
2. Massa Atom Relatif dan Massa Molekul Relatif
a. Massa Atom Relatif (Ar)
Massa atom relatif adalah perbandingan massa
rata-rata satu atom unsur tersebut terhadap 1/12 massa
satu atom isotop karbon -12 (12C).
Satu satuan massa atom disingkat sma
1 sma = 1/12 x massa satu atom 12C
Massa satu atom karbon = 19,93 x 10-24 gram
Jadi, 1 sma = 1/12 x (19,93 x 10-24 gram) = 1,66 x 10-24 gram
Contoh :
ArH = 1 , O = 16 dan S = 32
Tabel. Massa beberapa isotop
Untuk unsur yang mempunyai lebih dari satu
isotop, Ar merupakan nilai rata-rata dari setiap isotop.
Penentuan Ar tersebut dengan memperhitungkan kelimpahannya.
Misalnya, untuk suatu unsur mempunyai
dua macam isotop, berlaku persamaan
Dengan :
P1 = persentase kelimpahan isotop 1
P2 = persentase kelimpahan isotop 2
Dengan menggunakan persamaan tersebut, data
Ar setiap unsur dapat diperoleh. Dalam sistem periodik,
harganya ditulis apa adanya, tetapi dalam perhitungan
sering digunakan nilai pembulatannya.
Untuk unsur yang memiliki lebih dari dua isotop,
rumus tersebut dapat disesuaikan.
Tabel. Massa Atom Relatif (Ar-) Beberapa Unsur
b. Massa Molekul Relatif (Mr)
Massa molekul relatif adalah jumlah total Ar dari unsur-unsur penyusunnya.
Mr = ∑Ar
Tentukan
Mr C6H12O6 dan CH3COOH,
jika diketahui ArC = 12, H = 1, O = 16.
Penyelesaian
- Mr C6H12O6 = (6 x ArC) + (12 x ArH)
+ (6 x ArO)
= (6 x 12) + (12 x
1) + (6 x 16)
=
180
- Mr CH3COOH = (2 x ArC) + (4 x ArH) + (2 x ArO)
=
(2 x 12) + (4 x 1) + (2 x 16)
= 60
E. Sifat-Sifat Sistem Periodik
1. Jari-Jari Atom
Jari-jari atom adalah jarak elektron terluar ke inti
atom dan menunjukkan ukuran suatu atom. Jari-jari
atom sukar diukur sehingga pengukuran jari-jari atom
dilakukan dengan cara mengukur jarak inti antara dua
atom yang berikatan sesamanya.
Sifat-sifat
periodik unsur berdasarkan jari-jari
atomnya adalah semakin ke bawah, jumlah kulitnya
semakin banyak. Sehingga jari-jari atom akan semakin
besar. Selain itu, dalam satu periode, semakin ke
kanan jari-jari atom cenderung semakin kecil. Ha1 ini
terjadi karena semakin ke kanan jumlah proton dan
jumlah elektron semakin banyak, sedangkan jumlah kulit terluar yang terisi elektron tetap sama sehingga
tarikan inti tehadap elektron terluar semakin kuat.
2. Kelektronegatifan
Keelektronegatifan adalah kemampuan suatu
atom untuk menarik elektron dari atom lain. Harga
keelektronegatifan bersifat relatif (berupa harga perbandingan
suatu atom terhadap atom yang lain).
Dalam satu golongan, semakin ke atas harga keelektronegatifan
semakin besar. Ini terjadi karena gaya
tarik inti yang makin lemah. Selain itu unsur-unsur
dalam satu periode dari kiri ke kanan harga keelektronegatifan
semakin besar. Ha1 ini dikarenakan gaya
tarik inti yang makin kuat, sehingga mudah menarik
elektron dari luar.
Ingat, elektronegatif maksimal pada golongan VIIIA,
yang merupakan golongan gas mulia yang sudah
memiliki 8 elektron valensi.
Harga kelelektronegatifan penting untuk menentukan
bilangan oksidasi (biloks) unsur dalam suatu
senyawa. Jika harga keelektronegatifan besar, berarti
unsur yang bersangkutan cenderung menerima elektron
dan membentuk bilangan oksidasi negatif. Jika
harga keelektronegatifan kecil, unsur cenderung melepaskan
elektron dan membentuk bilangan oksidasi
positif. Jumlah atom yang diikat bergantung pada
elektron valensinya.
Tabel. Contoh Pembentukan Senyawa Berdasarkan Keelektronegatifan
3. Energi Ionisasi
Energi ionisasi pertama adalah energi yang diperlukan
untuk melepaskan elektron pada kulit terluar.
Pelepasan elektron kedua (dari ion positif satu)
disebut energi ionisasi kedua, pelepasan elektron
ketiga disebut energi ionisasi ketiga dan seterusnya.
Tahapan pelepasan elektron tersebut dapat digambarkan
sebagai berikut.
M(g) è
M+ (g) + e Ei – 1
M+(g) è M2+
(g) + e Ei
– 2 . . . . . . dan seterusnya
Semakin kecil jari-jari atom, harga energi ionisasi
akan semakin besar. Energi ionisasi unsur dalam satu
periode, semakin ke kanan akan semakin besar kecuali
energi ionisasi sebagai berikut:
- Unsur-unsur yang berada dalam golongan IIA lebih besar daripada unsur golongan IIIA yang berada di kanannya.
- Unsur-unsur yang berada dalam golongan VA lebih besar daripada golongan VIA yang berada di kanannya.
4. Afinitas Elektron
Afinitas elektron adalah energi yang dibebaskan
oleh suatu atom dalam wujud gs ketika menerima
sebuah elektron. Harga afinitas beberapa unsur terlihat
pada Gambar berikut, tanda negatif menunjukkan
energi dilepaskan.
5. Sifat Logam
Sifat logam sebagai berikut :
- Mengkilap
- Mengantarkan listrik
- Dapat ditempa menjadi lempengan tipis
- Dapat direntangkan menjadi kawat
- Cenderung menangkap elektron
Sifat-sifat periodik unsur berdasarkan sifat logamnya
sebagai berikut:
- Sifat logam pada unsur-unsur satu golongan pada tabel sistem periodik, semakin ke bawah semakin besar karena makin mudah melepaskan elektron (gaya tarik inti makin lemah)
- Sebaliknya, dalam satu periode, semakin ke kanan sifat logamnya akan makin berkurang, karena makin sulit melepaskan elektron.
6. Reaktivitas
Reaktivitas adalah sifat suatu unsur yang mudah
bereaksi, mudah menangkap dan melepaskan elektron.
Unsur logam dalam satu golongan di dalam
tabel sistem periodik unsur, semakin ke kanan, akan
semakin mudah melepaskan elektron, semakin mudah
bereaksi. Sifat ini berlawanan dengan sifat unsur
nonlogam.
7. Titil Leleh dan Titik Didih
Mendidih dan meleleh adalah suatu peristiwa
lepasnya ikatan gaya tarik menarik antara inti atom
dan elektronnya.
Unsur logam yang segolongan dalam tabel sistem
periodik unsur, semakin ke bawah, titik didih dan
titik lelehnya semakin rendah.
Hal ini disebabkan adanya
ikatan hidrogen.
Unsur nonlogam dalam 1 golongan, semakin ke
bawah, titik didih dan titik lelehnya semakin tinggi,
yang dipengaruhi oleh massa atom.
F. Perkembangan Teori dan Model Atom
Pada pembahasan mengenai struktur atom, Anda
telah mengetahui partikel dasar penyusun atom. Teori
dan model atom tersebut dikemukakan pada permulaan
abad ke-19. Bagaimanakah pendapat para ilmuwan
mengenai teori dan model atom sebelum abad ke-19.
Gagasan mengenai atom telah dikemukakan sejak
zaman Yunani. Konsep tersebut selalu berkembang
dan mengalami penyempurnaan. Berikut ini adalah
perkembangan teori dan model atom secara kronologis,
yang "dianggap benar" menurut jamannya.
1. Teori dan Model Atom Dalton
Model atom Dalton dianggap sebagai model atom
pertama yang cukup ilmiah, meski sebenarnya masih
bersifat spekulasi. Dalton menyempurnakan pendapat
mengenai model atom yang dikemukakan oleh
Leucippos dan Democritus. Mereka secara filosofis
menyatakan bahwa atom merupakan materi yang tak
terbagi. Menurut Dalton, atom merupakan partikel
terkecil suatu materi yang berbentuk bola. Bola-bola
atom tersebut khas untuk setiap unsurnya.
2. Teori dan Model Atom Thomson
Thomson menemukan partikel subatom bermuatan
negatif yang disebut elektron. Penemuan ini menggugurkan
model atom Dalton tentang partikel terkecil
karena di dalam atom, ternyata masih ada partikel-partikel.
Model atom Thomson merinci gambaran
atom Dalton dengan model "roti kismis"-nya.
Menurut Thomson, atom merupakan bola yang
bermuatan positif dan elektron menyebar di seluruh
bagian atom. Model atom Thomson dapat diibaratkan
kismis (sebagai analogi elektron) yang terdapat dalam
roti (sebagai analogi atom). Model. Atom Thomson
juga dapat digambarkan seperti buah semangka (analogi
atom dan bijinya (analogi elektron).
3. Teori dan Model Atom Ritherford
Ernest Rutherford merupakan salah seorang murid
Thomson. Ia menemukan inti atom yang memiliki
jari-jari jauh lebih kecil dibandingkan jari-jari atomnya.
Penemuan inti ini menggugurkan model atom
Thomson. Inti atom yang bermuatan positif berada
jauh di dalam atom, sedangkan elektron berputar mengelilinginya.
Berdasarkan hasil eksperimennya diperoleh,
Diameter inti atom = 10-13 cm, dan
Diameter atom = 10-8 cm.
Andaikan diameter inti atom diperbesar menjadi
1 cm atau kira-kira sebesar diameter kuku tangan
(diperbesar 1013 kali), diameter atom (letak elektron)
akan berjarak 105 cm atau 1 km.
Permasalahan lintasan elektron yang digambarkan
oleh Rutherford adalah bagaimana pengaruh gaya
tarik elektrostatik elektron yang bermuatan negatif
dan inti atom yang bermuatan positif. Menurut
Maxwell, jika elektron bergerak mengelilingi inti atom,
elektron akan kehilangan energi akibat pancaran
gelombang elektromagnetik dari suatu muatan yang berputar. Hal tersebut menyebabkan elektron bergerak
dengan lintasan yang semakin dekat ke inti, menyerupai
bentuk spiral, dan akhirnya akan jatuh ke inti.
4. Teori dan Model Atom Bohr
Penyempurnaan model atom Rutherford yang
berkaitan dengan lintasan elektron diiakukan oleh murid Rutherford sendiri. Ia
bernama Niels Bohr, Bohr mempunyai pendapat sebagai berikut.
a. Elektron
beredar mengelilingi inti atom dengan tingkat-tingkat energi tertentu. Semakin
dekat ke inti atom, tingkat energi semakin rendah. Dan sebaliknya semakin jauh
dari inti atom, tingkat energi semakin tinggi. Tingkat-tingkat energi ini
membentuk lintasan (orbit) elektron yang berupa lingkaran. Peredaran elektron
dalam lintasannya tersebut tidak membebaskan atau menyerap energi sehingga
bersifat stabil.
b. Perpindahan
elektron, dapat terjadi dengan cara:
1.) Menyerap
energi sehingga elektron tersebut berpindah ke tingkat energi yang lebih tinggi
atau lintasan yang lebih luar, atau
2) Mentbebaskan
energi sehingga elektron tersebut berpindah ke tingkat energi yang lebih rendah
atau lintasan yang lebih dalam.
Energi yang dibebaskan saat elektron
berpindah ke energi yang lebih rendah dapat diamati sebagai pancaran cahaya
dengan panjang gelombang tertentu. Spektrum cahaya atau gelombang elektromagnet
pada atom hidrogen dijadikan bukti oleh Bohr untuk mendukung model atomnya.
5. Teori dan Model Atom Mekanika Kuantum
Model lintasan elektron berupa lingkaran pada
model atom Bohr hanya cocok untuk atom hidrogen
yang memiliki satu elektron. Adapun untuk atom dengan
banyak elektron, bentuk lintasan tersebut ternyata
tidak sesuai.
Model atom mekanika kuantum atau model atom
mutakhir menggambarkan sifat pergerakan elektron
dan kedudukan elektron.vDasar pertama model atom
mekanika kuantum adalah hipotesis de Broglie. Menurut
Louis de Broglie, elektron bukan hanya merupakan
partikel, melainkan dapat juga dipandang sebagai
gelombang. Gerakan elektron dalam lintasannya juga
merupakan gelombang.
Dasar kedua adalah asas ketidakpastian Heisenberg.
Menurut Warner Heisenberg, kedudukan
elektron tidak dapat ditentukan secara eksak. Yang
dapat ditentukan hanyalah kebolehjadian atau peluang
ditemukannya elektron pada suatu posisi. Lintasan
bergeraknya elektron bukan merupakan sebuah
garis yang pasti, melainkan sebuah ruang.
Selanjutnya, Erwin Schrodinger berhasil merumuskan
persamaan gelombang gerakan elektron dalam
suatu atom. Persamaan gelombang tersebut merupakan
persamaan matematika yang bukan lagi berupa
fungsi garis (seperti lingkaran), melainkan fungsi
suatu ruang tiga dimensi (misalnya, bola). Elektron,
boleh jadi berpeluang berada atau ditemukan di dalam
ruang tersebut. Ruang ini dinamakan orbital, bentuknya
bervariasi sesuai persamaan matematikanya.
Referensi :
Redaksi Pustaka Merah Putih. 2008. 12 Kunci sistem Periodik Struktur Atom dan Persamaan Reaksi Kimia untuk SMA/MA. Yogyakarta : Pustaka Anggrek.






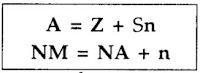






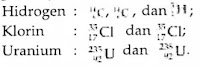






















0 comments:
Posting Komentar